La prima radiografia al mondo di un singolo atomo
Il rivoluzionario risultato si deve a un gruppo di scienziati americani e al loro innovativo rilevatore
Correva l’anno 1981 quando, grazie all’invenzione del microscopio a scansione di sonda, veniva direttamente osservato per la prima volta in laboratorio un singolo atomo.
Da allora tale operazione è diventata di routine, ma finora non si era mai riusciti ad ottenere lo stesso risultato usando invece i raggi X, che forniscono informazioni molto più dettagliate.
È quindi rivoluzionario quanto compiuto da un gruppo di scienziati americani guidati dal prof. Saw Wai Hla dell’Università dell’Ohio, che hanno effettuato la prima radiografia al mondo di un singolo atomo.
Di seguito andremo ad approfondire tale primato, ma prima ne approfitteremo per narrare brevemente la storia dell’atomo stesso.
Storia dell’atomo dagli antichi greci al Modello standard
L’atomo: indivisibile per la filosofia, ma non per la scienza
La parola “atomo”, usata per la prima volta dai filosofi dell’antica Grecia, deriva dal greco atomos, che significa indivisibile, ed è usata ancora al giorno d’oggi, sebbene impropriamente.
Fu però solo all’inizio del 1800, grazie a John Dalton, che si iniziò a studiare l’atomo dal punto di vista scientifico.
Dalton, infatti, scoprì che nei composti chimici i singoli elementi sono presenti in multipli interi di un’unità, che chiamò atomo basandosi sull’antico greco; da ciò il chimico ricavò la legge delle proporzioni multiple.
Nel 1897 J. J. Thomson scoprì che l’atomo non era la più piccola unità di materia.
Thomson, infatti, mentre effettuava degli esperimenti sui raggi catodici, si rese conto che le particelle di cui essi sono composti sono molto più leggere dell’idrogeno, cioè l’atomo più leggero esistente in natura.
Di conseguenza, il fisico realizzò che esse dovevano trovarsi all’interno degli atomi del catodo, e le chiamò corpuscoli, in seguito rinominate elettroni.
Il modello atomico di Thomson e la scoperta del nucleo
Il modello atomico di Thomson prevedeva che elettroni carichi negativamente fossero distribuiti in un mare di carica positiva presente all’interno dell’atomo.
Ma esperimenti eseguiti da Ernest Rutherford, Hans Geiger ed Ernest Marsden tra il 1908 e il 1913 dimostrarono che non era così.
Bombardando delle lamine di metallo con particelle alfa (cioè, particelle cariche positivamente emesse da alcune sostanze radioattive, come il radio), i tre notarono che tali particelle venivano deviate di un angolo superiore ai 90 gradi.
Per spiegare ciò, era necessario che la carica positiva non fosse sparpagliata per tutto l’atomo, ma bensì concentrata in un punto molto piccolo (quello che oggi è conosciuto come nucleo), in modo da produrre un campo elettrico abbastanza forte da deviare di così tanto le particelle alfa.
L’atomo ridefinito dalla meccanica quantistica
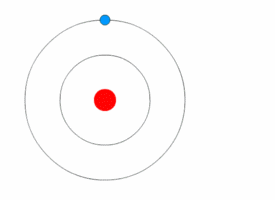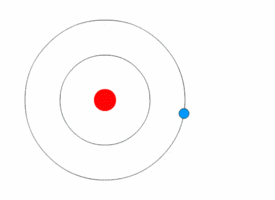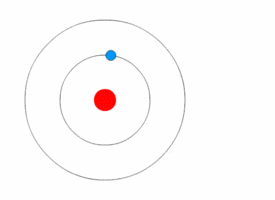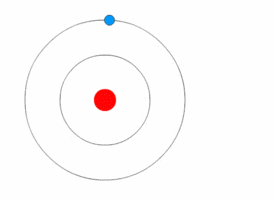
Nel 1913 Niels Bohr, uno dei padri della teoria quantistica, propose un nuovo modello di atomo in cui gli elettroni orbitassero attorno al nucleo, ma solo in una serie limitata di orbitali, e potessero passare dall’uno all’altro solo in seguito al guadagno o alla perdita di una quantità di energia (quanto) ben definita.
Tale quantizzazione era il motivo per cui le orbite degli elettroni rimanevano stabili, invece di decadere come ci si aspetterebbe quando corpi in accelerazione perdono energia cinetica.
Nello stesso anno Henry Moseley confermò sperimentalmente e perfezionò l’idea di Rutherford e di Antonius van den Broek che all’interno del nucleo si trovassero un numero di cariche nucleari positive (qualche anno dopo denominate protoni) pari al numero indicato nella tabella periodica degli elementi (il cosiddetto numero atomico).
Il modello di Bohr fu ulteriormente raffinato da un altro dei padri fondatori della meccanica quantistica, Erwin Schrödinger,
Basandosi sull’intuizione di Louis de Broglie che tutte le particelle si comportano in parte anche come onde, nel 1926 Schrödinger propose un modello atomico in cui gli elettroni erano dipinti come onde tridimensionali, invece che punti monodimensionali.
Un’importante conseguenza di ciò è che è matematicamente impossibile ottenere allo stesso tempo una misura precisa della posizione e della quantità di moto (cioè, massa moltiplicata per velocità) di un elettrone.
Tale teorema, noto come Principio di indeterminazione, fu formulato esplicitamente l’anno successivo da un altro gigante della meccanica quantistica, Werner Heisenberg.
Applicandolo all’atomo, si ottiene finalmente il modello che è ancora oggi considerato come corretto, in base al quale esistono una serie di zone attorno al nucleo, dette orbitali atomici, in cui vi è maggiore probabilità di trovare un elettrone.
Neutroni, quark e Modello standard
Risale al 1932, grazie al lavoro di James Chadwick, la scoperta nel nucleo atomico del neutrone, una particella priva di carica e con massa simile a quella del protone.
Per un ventennio sembrò che non ci fosse più niente da rilevare riguardo l’atomo, ma ancora una volta le sorprese erano all’orizzonte.
Infatti, negli anni 50 del secolo scorso, furono sviluppati acceleratori e rilevatori di particelle molto più avanzati, che consentirono di studiare cosa succede quando gli atomi si scontrano ad alte velocità ed energie.
Si scoprì, quindi, che protoni e neutroni non erano particelle elementari come si pensava, ma si componevano a loro volta di particelle più piccole, chiamate quark.
Ciò portò allo sviluppo del cosiddetto Modello standard delle particelle, che ancora oggi è quanto di meglio abbiamo a disposizione per spiegare le proprietà del nucleo degli atomi al livello dei quark e le forze che governano le interazioni tra queste particelle.
Dalla scoperta dei raggi X alla radiografia di un singolo atomo
I raggi X furono scoperti da Wilhelm Röntgen nel 1895, cioè due anni prima della scoperta che l’atomo fosse divisibile, e sono usati ad esempio per esami medici, per controlli di sicurezza negli aeroporti o per identificare la tipologia di materiali presenti in un campione.
Quest’ultimo utilizzo è quello che ci riporta agli atomi: finora la quantità radiografabile più piccola era l’attogrammo, corrispondente a circa 10000 atomi, a causa dell’estrema debolezza del segnale a raggi X prodotto da un atomo.
Si può ben capire, quindi, l’enorme balzo in avanti fatto dal prof. Hia e dal suo team nel riuscire a radiografare un singolo atomo, come riporta Samantha Pelham sul sito dell’Università dell’Ohio.
Per farlo, il gruppo ha realizzato e perfezionato per ben 12 anni un rilevatore specializzato, costituito da una punta metallica affilata posizionata in estrema prossimità del campione, per raccogliere gli elettroni “eccitati” dai raggi X - una tecnica nota come SX-STM.
Come ulteriore “bonus”, tale tecnica riesce anche a rilevare gli stati chimici di singoli atomi, anche quelli rari come il terbio, che ad esempio si è scoperto essere poco interattivo con l’ambiente circostante.

Impatti della capacità di radiografare un singolo atomo
La possibilità di tracciare materiali con una definizione a livello del singolo atomo non potrà che avere un impatto enorme nel campo delle scienze mediche e ambientali, oltre che in quello dell’informazione quantistica (cioè, a livello microscopico) e per la realizzazione di strumentazione avanzata nel campo della scienza dei materiali.
Inoltre, molti materiali rari (come il suddetto terbio) sono utilizzati nella produzione di dispositivi di uso comune come cellulari, computer e televisori: la possibilità di manipolare in maniera più efficace tali materiali consentirà di affrontare al meglio le sempre nuove esigenze tecnologiche che si presenteranno.
Insomma, nei prossimi anni è lecito aspettarsi una vera e propria rivoluzione in numerosi campi della scienza e della tecnica.



Ineccepibile come sempre. Bellissimo articolo. Ne voglio ancora.